Строение атома.
Атом – мельчайшая частица химического элемента, носитель всех его химических свойств. Атом неделим в химическом отношении. Атомы могут существовать как в свободном состоянии, так и в соединении с атомами того же элемента или другого элемента.
За единицу атомных и молекулярных масс в настоящее время приняли 1/12 часть массы атома углерода с атомной массой, равной 12 (изотоп 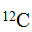 ). Эту единицу называют углеродной единицей.
). Эту единицу называют углеродной единицей.
Масса и размеры атомов. Число Авогадро.
Грамм-атом, так же как и грамм-молекула любого вещества, содержит 6,023•10^23 атомов или соответственно молекул. Это число называется числом Авогадро (N0). Так, в 55,85 г железа, 63,54 г меди, 29,98 г алюминия, и т. п. находится число атомов, равное числу Авогадро.
Зная число Авогадро, нетрудно подсчитать массу одного атома любого элемента. Для этого гpaмм-атомную массу одного атома надо разделить на 6,023•10^23 . Так, масса атома водорода (1) и масса атома углерода (2) соответственно равны:
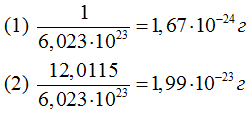
Исходя из числа Авогадро, можно оценить и объем атома. Например, плотность меди равна 8,92 г/см^3, а грамм-атомная масса 63,54 г. Значит, один грамм-атом меди занимает объем 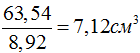 , и на один атом меди приходится объем
, и на один атом меди приходится объем 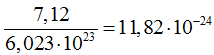 .
.
Атом является сложным образованием и состоит из ряда более мелких частиц. Атомы всех элементов состоят из положительно заряженного ядра и электронов — отрицательно заряженных частиц очень малой массы. Ядро занимает ничтожно малую часть всего объема атома. Диаметр атома равен 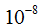 см, а диаметр ядра -
см, а диаметр ядра - 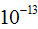 см.
см.
Хотя диаметр ядра атома в 100000 paз меньше диаметра самого атома, практически вся масса атома сосредоточена в его ядре. Отсюда следует, что плотность атомных ядер очень велика. Если бы удалось собрать 1 см3 атомных ядер, то его масса была бы около 116 млн. тонн.
Ядро состоит из протонов и нейтронов. Эти частицы имеют общее название — нуклоны.
Протон - 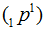 - устойчивая элементарная частица с массой, близкой к углеродной единице. Заряд протона равен заряду электрода, но с обратным знаком. Если заряд электрона принимают равным —1, то заряд протона равен +1. Протон – это атом водорода, лишенный электрона.
- устойчивая элементарная частица с массой, близкой к углеродной единице. Заряд протона равен заряду электрода, но с обратным знаком. Если заряд электрона принимают равным —1, то заряд протона равен +1. Протон – это атом водорода, лишенный электрона.
Нейтрон – атомная оболочка, отрицательный заряд которой компенсирует положительный заряд ядра, обусловленный наличием в нем протонов.
Таким образом, количество электронов в атоме равно количеству протонов в его ядре.
Зависимость между числом протонов , числом нейтронов и массовым числом атома выражается уравнением: N=A-Z
Отсюда число нейтронов в ядре атома любого элемента равно разности между его массовым числом и числом протонов.
Так число нейтронов в ядре атома радия с массой 226 N=A-Z=226-88=138
Все химические процессы образования и разрушения химических соединений происходят без изменения ядер атомов элементов, входящих в состав этих соединений. Изменения претерпевают только электронные оболочки. Химическая энергия, таким образом, связанa с энергией электронов. Чтобы понимать процессы образования и разрушения химических соединений, следует иметь представления о свойствах электрона вообще и особенно о свойствах и поведении электрона в атоме.
Электрон — это элементарная частица, обладающая элементарным отрицательным электрическим зарядом, т. е. наименьшим могущим существовать количеством электричества. Заряд электрона равен 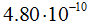 эл. ст. ед. или
эл. ст. ед. или 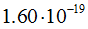 кулона. Масса покоя электрона равна
кулона. Масса покоя электрона равна 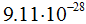 г, т.е. в 1837,14 раза меньше массы атома водорода. Масса электрона составляет
г, т.е. в 1837,14 раза меньше массы атома водорода. Масса электрона составляет 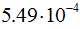 углеродной единицы.
углеродной единицы.
В начале XX века М. Планк А. Эйнштейн создали квантовую теорию света, согласно которой свет является потоком отдельных квантов энергии, которую нecyт частицы света — фотоны.
Величина кванта энергии (E) различна для различных излучений и пропорциональна частоте колебаний 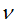 :
:
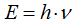 ,
,
где h - постоянная Планка.
М. Планк показал, что атомы поглощают или испускают лучистую энергию только отдельными вполне определенными порциями – квантами.
Пытаясь увязать закон классической механики с квантовой теорией датский ученый Н. Бор считал, что электрон в атоме водорода может находиться лишь на определенных — постоянных орбитах, радиусы которых относятся друг к другу как квадраты целых чисел 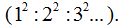 Эти орбиты Н. Бором были названы стационарными.
Эти орбиты Н. Бором были названы стационарными.
Излучение энергии происходит только при переходе электрона с более дальней орбиты на более близкую к ядру орбиту. При переходе же электрона с болей близкой орбиты на более дальнюю энергия атомом поглощается.
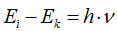 , где
, где 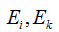 - энергии электронов в стационарных состояниях.
- энергии электронов в стационарных состояниях.
При Ei > Ек энергия выделяется.
При Ei < Ек энергия поглощается.
Решение вопроса о распределении электронов в атоме основано на изучении линейчатых спектров элементов и их химических свойств. Спектр атома водорода почти полностью подтверждал теорию Н. Бора. Однако наблюдаемое расщепление спектральных линий у многоэлектронных атомов и усиление этого расщепления в магнитном и - электрических полях теория Н. Бора объяснить не могла.
Законы классической физики противопоставляют друг другу понятия «частица» и «волна». Современная физическая теория, получившие название квантовой, или волновой механики, показала, что движение и взаимодействие частиц малой массы — микрочастиц происходят по законам, отличным от законов классической механики. Микрочастице одновременно присущи некоторые свойства корпускул (частиц) и некоторые свойства волн. С одной стороны, электрон, протон или другая микрочастица движется и действует подобно корпускуле, например, при соударении с другой микрочастицей. С другой стороны, при движении микрочастицы обнаруживаются типичные для электромагнитных волн явления интерференции и дифракции.
Таким образом, в свойствах электрона (как и других микрочастиц), в законах его движения проявляются неразрывность и взаимосвязь двух качественно различных форм существования материи, вещества и поля. Микрочастицу нельзя рассматривать ни как обыкновенную частицу, ни как обыкновенную волну. Микрочастица обладает корпускулярно-волновым дуализмом.
Говоря о взаимосвязи вещества и поля, можно прийти к выводу, что, если каждой материальной частице присуща определенная масса, то, по-видимому, этой же частице должна отвечать и определенной длины, волна. Возникает, вопрос о взаимосвязи массы и волны. В 1924 году французский физик Луи де Бройль высказал предположение, что с каждым движущимся электроном (и вообще с каждой движущейся материальной частицей) связан волновой процесс, длина волны которого 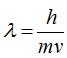 , где
, где 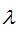 - длина волны в см(м), h - постоянная Планка, равная
- длина волны в см(м), h - постоянная Планка, равная 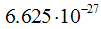 эрг. сек (
эрг. сек (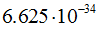 ), m — масса частицы в г (кг),
), m — масса частицы в г (кг), 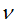 - скорость частицы, в см/сек.
- скорость частицы, в см/сек.
Из этого уравнения видно, что частица, находящаяся в покое, должна иметь бесконечно большую, длину волны и что длина волны уменьшается с увеличением скорости частицы. Длина волны у движущейся частицы большой массы очень мала и экспериментально ее определить пока нельзя. По тому мы говорим о волновых свойствах только микрочастиц. Электрон обладает волновыми свойствами. Это значит, что его движение в атоме можно описать волновым уравнением.
Планетарная модель строения атома водорода, созданная Н. Бором, который исходил из представления об электроне только как классической частице, не может объяснить целого ряда свойств электрона. Квантовая механика показала, что представление о движении электрона вокруг ядра по определенным орбитам подобно движению планет вокруг Солнца, следует считать несостоятельным.
Электрон, обладая свойствами волны, движется по всему объему, образуя электронное облако, которое для электронов, находящихся в одном атоме, может иметь различную форму. плотность этого электронного облака в той или иной части атомного объема неодинакова.
Характеристика электрона четырьмя квантовыми числами.
Основная характеристика, определяющая движение электрона в поле ядра,— это его энергия. Энергия электрона, как и энергия частицы светового потока — фотона, принимает не любые, а лишь определенные дискретные, прерывные или, как говорят, квантующиеся значения.
Движущийся электрон обладает тремя степенями свободы перемещения в пространстве (соответственно трем координатным осям) и одной дополнительной степенью свободы, обусловленной наличием у электрона собственного механического и магнитного моментов, которые учитывают вращение электрона вокруг своей оси. Следовательно, для полной энергетической характеристики состояния электрона в атоме необходимо и достаточно иметь четыре параметра. Эти параметры получили название квантовых чисел. Квантовые числа, так же как и энергия электрона, могут приникать не все, а лишь определенные значения. Соседние значения квантовых чисел различаются на единицу.
Главное квантовое число n характеризует общий запас энергии электрона или его энергетический уровень. Главное квантовое число может принимать значения целых чисел от 1 до 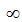 . Для электрона, находящегося в поле ядра главное квантовое число может принимать значения от 1 до 7 (соответственно номеру периода в периодической системе, в котором находится элемент). Энергетические уровни обозначаются или цифрами в соответствии со значениями главного квантового числа, или буквами:
. Для электрона, находящегося в поле ядра главное квантовое число может принимать значения от 1 до 7 (соответственно номеру периода в периодической системе, в котором находится элемент). Энергетические уровни обозначаются или цифрами в соответствии со значениями главного квантового числа, или буквами:
п | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
Обозначение уровня | K | L | M | N | O | P | Q |
Если, например, n=4, то электрон, находится на четвертом, считая от ядра атома, энергетическом уровне, или на N уровне.
Орбитальное квантовое числа l, которое иногда называют побочным квантовым числом, характеризует различное энергетическое состояние электрона данного уровня. Тонкая структура спектральных линий говорит о том, что электроны каждого энергетического уровня группируются в подуровни. Орбитальное квантовое число связано с моментом количества движения электрона при его движении относительно ядра атома. Орбитальное квантовое число определяет также форму электронного облака Квантовое число l может принимать все целочисленные значения от 0 до (п-1). Например, при n=4, l=0, 1, 2, 3. Каждому значению l соответствует определенный подуровень. Для подуровней применяются буквенные обозначения. Так, при l=0, 1, 2, 3 электроны находятся соответственно на s-, p-, d-, f- подуровнях. Электроны различных подуровней соответственно называют s-, p-, d-, f - электронами. Возможное число подуровней для каждого энергетического уровня равно номеру этого уровня, но не превышает четырех. Первый энергетический уровень (п=1) состоит из одного s-подуровня, второй (п=2), третий (п=3) и четвертый (п=4) энергетические уровни состоят соответственно из двух (s, p), трех (s, p, d) и четырех (s, p, d, f) подуровней. Больше четырех подуровней не может быть, так как значения l=0, 1, 2, 3 описываю электроны атомов всех 104 известных сейчас элементов.
Если l=0 (s-электроны), то момент количества движения электрона относительно ядра атома равен нулю. Это может быть только когда электрон поступательно движется не вокруг ядра, а от ядра к периферии и обратно. Электронное облако s-электрона имеет форму шара.
Магнитное квантовое число - c моментом количества движения электрона связан и его магнитный момент. Магнитное квантовое число характеризует магнитный момент электрона. магнитное квантовое число характеризует магнитный момент электрона и указывает на ориентацию электронного облака относительного избранного направления или относительно направления магнитного поля. Магнитное квантовое число может принимать любые целые положительные и отрицательные значения, включая и ноль в пределах от – l до + l. Например, если l=2, то имеет 2 l+1=5 значений (-2, -1, 0, +1, +2). При l=3 число значений равно 2 l+1=7 (-3, -2, -1, 0, +1, +2, +3). Число значений магнитного квантового числа , которое равно 2 l+1, - это число энергетических состояний, в которых могут находиться электроны данного подуровня. Таким образом, s-электроны имеют лишь одно состояние (2 l+1=1), p-электроны – 3 состояния (2 l+1=3), d-, f-электроны – соответственно 5 и 7 состояний. Энергетические состояния принято обозначать схематически энергетическими ячейками, изображая их в виде прямоугольников, а электроны в виде стрелок в этих ячейках.
Спиновое квантовое число - характеризует внутреннее движение электрона — спин. Оно связано с собственным магнитным моментом электрона, обусловленным его движением вокруг своей оси. Это квантовое число может принимать только два значения: + 1/2 и —1/2, в зависимости от того, параллельно или антипараллельно магнитному полю, обусловленному движением электрона вокруг ядра, ориентируется магнитное поле спина электрона.
Два электрона (пара) с одинаковыми значениями квантовых чисел: n, I, , но с противоположно направленными спинами (↑ ↓) называются спаренными или неподеленной парой электронов. Электроны с ненасыщенными спинами (↑↑) называются неспаренными.
Принцип Паули, принцип наименьшей энергии, правило Гунда.
Распределение электронов в атомах элементов определяют три основных положения: принцип Паули, принцип наименьшей энергии и правило Гунда.
Принцип Паули. Изучая многочисленные, спектры атомов швейцарский физик В. Паули в 1925 году пришел к выводу, который получил название принципа или запрета Паули: „Двум электронам атома запрещено быть во всех отношениях похожими друг на друга" или, что то же самое, „в атоме не может быть даже двух электронов с одинаковыми значениями всех четырех квантовых чисел". Энергетические состояния электронов, характеризуемые одинаковыми значениями трех квантовых чисел: n, I и m1 принято обозначать энергетической ячейкой  .
.
Согласно принципу Паули, в энергетической ячейке может быть только два электрона, причем с противоположными спинами 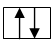
Нахождение в одной энергетической ячейке третьего электрона означало бы, что у двух из них все четыре квантовых числа одинаковы. Число, возможных состояний электронов (рис. .4) на данной подуровне равно числу значений магнитного квантового числа для этого подуровня, т. е. 21+ 1. Максимальное число электронов на этом подуровне, согласно принципу Паули будет 2(21+ 1). Таким образом, на s-подуровне возможно 2 электрона ; на p-подуровне 6 электронов ; на d-подуровне 10 электронов ; на f-подуровне 14 электронов . Число возможных состояний электронов на каком-либо уровне равно квадрату главного квантового числа 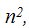 а максимальное число электронов на этом уровне
а максимальное число электронов на этом уровне 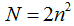
Последовательность размещения электронов в атоме должна отвечать наибольшей связи их с ядром, т. е. электрон, должен обладать наименьшей энергией. Поэтому электрону необязательно занимать вышележащий энергетический уровень, если в нижележащем уровне есть места, располагаясь на которых электрон будет обладать меньшей энергией.
Так как энергия электрона в основном определяется значениями главного n и орбитального / квантовых чисел, то сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и / является меньшей. Например, запас энергии на подуровне 4s(n +/ = 4 +0 = 4) меньше, чем на 3d(n + /= 3 + 2 = 5); на 5s (n + / = 5 + 0 = 5) меньше, чем на 4d(n + / = 4 + 2 = 6); на 5р(п + / = 5 +1 =6) меньше, чем на 4f(n + 1 = 4+3 = 7). Если для двух уровней суммы значений n и / равны, то сначала идет заполнение подуровня с меньшим значением п. Например, на подуровнях 3d, 4p, 5s суммы значений n и / равны пяти, в этом случае сначала заполняются подуровни с меньшими значениями главного квантового числа n, т. е. в следующей последовательности: 3d-4р-5s.
Когда энергии близких подуровней очень мало отличаются друг от друга, встречаются некоторые исключения из этого правила. Так, подуровень 5d заполняется одним электроном 5dl раньше 4f; 6d1-2 раньше 5f.
Заполнение энергетических уровней и подуровней идет в следующей последовательности: ls→2s→2p→3s→3p→4s→ 3d → 4р→ 5s → 4d → 5р→ 6s →(5dl) →4f→ 5d→6p→ 7s→ (6d1-2)→5f→ 6d→7p
Правило Гунда.
Электроны в пределах данного подуровня располагаются сначала каждый в отдельной ячейке в виде неспаренных „холостых" электронов. Иными словами, при данном значении I электроны в атоме располагаются так, что суммарное спиновое число их 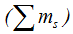 максимально. Например, если в трех р-ячейках надо разместить три электрона, то каждый из них будет располагаться в отдельной ячейке таким образом:
максимально. Например, если в трех р-ячейках надо разместить три электрона, то каждый из них будет располагаться в отдельной ячейке таким образом:
Электронные формулы атомов и схемы.
Принимая во внимание рассмотренные положения, легко представить распределение электронов по энергетическим уровням и подуровням в атомах любого элемента. Это распределение электронов в атоме записывается в виде так называемых электронных формул. В электронных формулах буквами s, p, d, f обозначаются энергетические подуровни электронов; цифры впереди букв означают энергетический уровень, в котором находится данный электрон, а индекс вверху справа - число электронов на данном подуровне. Например, запись 5р3 оначает, что 3 электрона располагаются на р-подуровне пятого энергетического уровня.
Чтобы составить электронную формулу атома любого элемента, достаточно знать номер данного элемента в периодической системе и выполнить основные положения, которым подчиняется распределение электронов в атоме.
Пусть, например, нужно составить электронные формулы для атомов серы, кальция, скандия, железа и лантана. Из периодической таблицы определяем номера данных элементов, которые соответственно равны 16, 20, 21, 26, . Это значит, что на энергетических уровнях и подуровнях у атомов данных элементов содержится соответственно 16, 20, 21, 26, 57 электронов. Соблюдая принцип Паули и принцип наименьшей энергии, т. е. последовательность заполнения энергетических уровней и подуровней, можно составить электронные формулы атомов этих элементов:
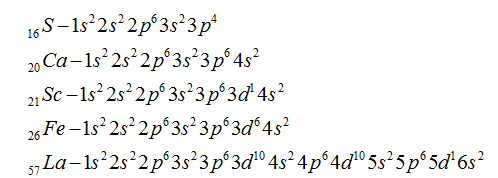
Структура электронной оболочки атома может быть изображена и в виде схемы размещения электронов по энергетическим ячейкам.
Для атомов железа такая схема имеет следующий вид:
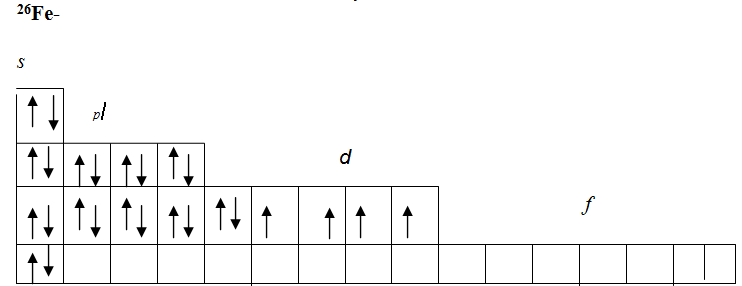
На этой схеме наглядно видно выполнение правила Гунда. На Зd-подуровне максимальное количество, ячеек (четыре) заполнено неспаренными электронами. Изображение структуры электронной оболочки в атоме в виде электронных формул и в виде схем наглядно не отражает волновых свойств электрона. Однако следует помнить, что для каждого s-, р-, d-, f-электрона характерно свое электронное облако. Различная форма электронного облака указывает на то, что электрон имеет неодинаковую вероятность нахождения в данной области пространства атома. В зависимости от значения магнитного квантового числа m1 ориентация электронного облака в пространстве будет также различной.