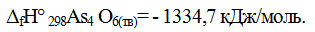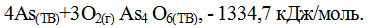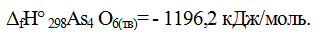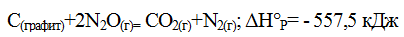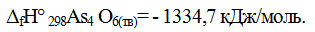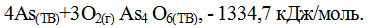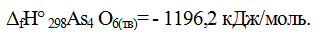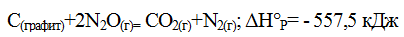Основы химической термодинамики.
Термодинамика - наука о превращениях различных форм энергии и законах этих превращений. Та область термодинамики, которая занимается изучением энергетических изменений в химических реакциях, называется химической термодинамикой. Химическая термодинамика применяет законы термодинамики к поведению веществ в химических реакциях.
К важнейшим величинам химической термодинамики, характеризующим химические системы, относятся внутренняя энергия U, энтальпия Н, энтропия S, энергия Гиббса G. Все эти величины представляют собой функции состояния, т.е. зависят только от состояния системы, но не от способа, которым достигнуто это состояние; они определяются только конечным и начальным состоянием и не зависят от пути процесса.
Внутренняя энергия системы.
Внутренняя энергия любой системы состоит из энергии составляющих ее частей, т.е. атомов и молекул. Энергии атомов и молекул состоят из кинетической энергии движения, энергии взаимодействия электронов и ядер, потенциальной энергии межмолекулярного взаимодействия и т.д. Однако в настоящее время не существуют методы определения внутренней энергии. Поэтому в термодинамических расчетах определяют изменение внутренней энергии:
ΔU=U2-U1
Первый закон термодинамики.
Первый закон термодинамики: для изолированной системы (для которой исключен любой материальный или энергетический обмен с окружающей средой) внутренняя энергия постоянна (U=const, ΔU=0).
Внутренняя энергия является экстенсивной величиной, то есть зависит от массы системы, в отличие от интенсивных величин (давления, температуры), не зависящих от массы.
Протекание химической реакции сопровождается изменением внутренней энергии реагирующих систем. Если внутренняя энергия системы уменьшается (ΔU<0), то реакция протекает с выделением энергии (экзотермические реакции). Если же внутренняя энергия системы возрастает (ΔU>0), то процесс сопровождается поглощением энергии из внешней среды (эндотермические реакции).
Если в результате протекания химической реакции система поглотила количество теплоты Q и совершила работу А, то изменение внутренней энергии ΔU определяется уравнением
ΔU =Q-A.
Согласно закону сохранения энергии, ΔU зависит только от начального и конечного состояния системы, но не зависит от способа осуществления процесса. Напротив, Q и А при разных способах осуществления процесса будут различаться: функцией состояния является только разность этих величин, но не каждая из них в отдельности. Функции U, Q, А обычно выражаются в Дж или кДж.
Если реакция протекает при постоянном объеме (ΔV=0, изохорный процесс), то работа расширения системы (А=Р* ΔV, где Р = давление системы) равна нулю. Если при этом не совершаются другие виды работы (например, электрическая), то ΔU = QV,
где Qv - тепловой эффект реакции (т.е. количество поглощенной системой теплоты), протекающей при постоянном объеме.
В случае экзотермической реакции Qv<0, для эндотермической реакции Qv>0.
Химические реакции чаще осуществляются не при постоянном объеме, а при постоянном давлении (ΔР=0, изобарный процесс). В подобных случаях для характеристики процесса удобнее пользоваться не внутренней энергией, а энтальпией Н.
Энтальпия системы. Термохимия.
Энтальпия определяется соотношением
H=U+P*ΔV.
Как видно, энтальпия имеет ту же размерность, что и внутренняя энергия, и поэтому обычно выражается в Дж или кДж.
При постоянном давлении
ΔH=ΔU+P* ΔV,
т.е. изменение энтальпии равно сумме изменения внутренней энергии и совершенной системой работы расширения. Если при этом никакие другие виды работы не совершаются, то
ΔH=QP,
где Qp — тепловой эффект реакции, протекающей при постоянном давлении.
Для экзотермической реакции Qp<0, для эндотермической Qp>0.
Изменение внутренней энергии или энтальпии принято относить к тому случаю, когда все исходные вещества и все продукты реакции находятся в стандартных состояниях. Стандартным состоянием вещества называется его состояние в виде чистого вещества при давлении (в случае газов - при парциальном давлении данного газа), равном нормальному атмосферному давлению (101,325 кПа или 760 мм рт.ст.) и температуре 298,15 К. Условия, при которых все участвующие в реакции вещества находятся в стандартных состояниях, называются
стандартными условиями протекания реакции.
Отнесенные к стандартным условиям изменения соответствующих величин, называются стандартными изменениями и их обозначения снабжаются верхним индексом °: ΔU0 -. стандартное изменение внутренней энергии при химической реакции, АН0 - стандартное изменение энтальпии при химической реакции.
Стандартная энтальпия реакции образования 1 моля данного вещества из простых веществ называется стандартной энтальпией образования этого вещества, она измеряется в кДж/моль. Например:
Знак f означает теплоту образования из простых веществ, т.е.
Теплота образования конкретного вещества может быть различной в зависимости от его агрегатного состояния. Например:
Химические уравнения, в которых указаны изменения энтальпии (тепловые эффекты реакции), называются
термохимическими уравнениями.
Раздел химической термодинамики, изучающий тепловые эффекты химических реакций, называется
термохимией. Реакция, в результате которой выделяется теплота, называется экзотермической (-ΔН), если поглощается - эндотермической (+ΔН). В термохимических уравнениях также указываются агрегатные состояния реагирующих веществ и продуктов реакции.
В 1840 г. академик Гесс вывел закон: тепловой эффект химической реакции зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
Из закона Гесса следует, что термохимические уравнения можно складывать, вычитать и умножать на численные множители.
Пример: исходя из теплоты образования газообразного СО2 (ΔfH°= - 393,5 кДж/моль) и термохимического уравнения:
вычислить теплоту образования N2O.
Решение: запишем термохимическое уравнение образования N2O(г) из простых веществ