Атомно-молекулярное учение в химии.
Исключительное значение для развития химии имело атомно-молекуляр¬ное учение, колыбелью которого является Древняя Греция. Атомистику древнегреческих материалистов отделяют от нас более 20 веков, однако логика греков поражает настолько, что философское учение о дискретном строении материи, развитое ими, невольно сливается в сознании с нашими сегодняшними представлениями.
Еще Левкипп (V в. до н.э.) утверждал: материальный мир дискретен, он состоит из мельчайших частиц и пустоты.
Ученик Левкиппа Демокрит (460-370 гг. до н.э.) назвал эти мельчайшие частицы атомами (от греч. атомос - неделимый). Эта название мы используем и сегодня. Демокрит, развивая новое учение "атомистику", приписал атомам такие свойства, как размер и форма, способность к движению.
Однако одна из гениальных догадок человеческого разума была предана забвению. Об учении атомистов не вспоминали почти 20 веков. И лишь в XVII в. идеи древнегреческих атомистов были возрождены Пьером Рассенди (1592-1655 гг.).
В дальнейшем атомно-молекулярное учение развил М.В. Ломоносов. Основные положения этого учения изложены в его работе "Элементы математической химии" (1741 г.) и ряде других.
Сущность этого учения можно свести к следующим положениям:
1) все вещества состоят из "корпускул" (так Ломоносов называл молекулы);
2) молекулы состоят из '"элементов" (так он называл атомы);
3) частицы - молекулы и атомы - находятся в непрерывном движении;
4) молекулы простых веществ состоят из одинаковых атомов, молекулы
сложных веществ - из различных атомов.
Атомно-молекулярное учение в химии окончательно утвердилось лишь в середине XIX в. На Международном съезде химиков в Карлсруэ в 1860 г. были приняты определения понятий "молекула" и "атом".
Молекула - это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением.
Атом - наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям: атом - это электронейтральная частица, состоящая из положительно заряженного ядра атома и отрицательно заряженных электронов.
Некоторые основные понятия химии.
Важнейшей характеристикой атома является положительный заряд ядра, численно равный порядковому номеру элемента периодической системы. В настоящее время известно 107 элементов. Каждый из них обозначают особым знаком (символом), представляющим собой первую букву латинского названия элемента, или же первую и одну из последующих букв.
Как впервые установил Д.И.Менделеев, наибольшее распространение в природе имеют элементы "малого атомного веса (атомной массы), в организмах же исключительно преобладают легчайшие (Н, С, N, О)". В космосе также наиболее распространены самые легкие элементы - водород и гелий.
С точки зрения химии вещество - это определенная совокупность атомных и молекулярных частиц, их ассоциатов и агрегатов, находящихся в любом из трех агрегатных состояний.
Отсюда простые вещества - это вещества, состоящие из атомов одного и того же химического элемента. Например, простое вещество хлор образовано атомами элемента хлор. А сложные вещества, (химические соединения) - это вещества, образующиеся при химическом взаимодействии атомов разных
химических элементов (Ag2O, H2O, CuO и т.д.).
Понятие "простое вещество" нельзя отождествлять с понятием "химический элемент". Простое вещество характеризуется определенной растворимостью, плотностью, температурами плавления и кипения и др. Эти свойства относятся к совокупности атомов и для разных простых веществ они различны. Химический элемент характеризуется определенным положительным зарядом ядра (Порядковым номером), изотопным составом, степенью окисления и т.д. Свойства элементов относятся к его отдельным атомам.
Сложные вещества состоят не из простых веществ, а из элементов, Например, углекислый газ СО2состоит не из простых веществ углерода и кислорода, а из элементов углерода и кислорода.
Наряду с химическими соединениями существуют смеси, которые, как и соединения, состоят из атомов разных видов. Однако, в отличие от химического соединения, в смеси того же состава атомы не вступают между собой в химическое взаимодействие и, как следствие, не образуют молекулы.
Моль и эквивалент – единицы количества вещества.
Важнейшими характеристиками химического вещества являются его атомная масса, а для молекул - молекулярная масса.
Атомная масса - это число, которое показывает, во сколько раз мacca данного атома больше 1/12 массы самого легкого изотопа углерода.
Молекулярная масса - это число, показывающее, во сколько раз молекула вещества тяжелее 1/12 атома изотопа 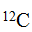 . Молекулярная масса химического соединения равна сумме атомных масс всех атомов, составляющих молекулу соединения.
. Молекулярная масса химического соединения равна сумме атомных масс всех атомов, составляющих молекулу соединения.
Моль вещества - это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 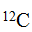 .
.
Число структурных единиц, содержащихся в 1 моле вещества, определено с большой точностью, и оно равно 6,02*10^23 моль"'. Число 6,02*10^23 называется числом Авогадро, обозначается как 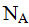
Например: молекулярная масса кислорода О2 равна 32 а.е.м. (кислорода -16, итого 16+16=32). Значит, один моль кислорода равен по массе 32 граммов, и эта масса кислорода содержит 6,02*10^23 молекул воды.
Аналогично, масса 1 моля соды Na2СО3 равна 106 граммов (23+23+12+16+16+16=106), а масса одной молекулы Na2CO3 равна: 106г/6,02*1023 = 17,6*10'23г.
Количество вещества n и масса вещества m связаны между собой
формулой
m = n*М,
где М - молекулярная масса вещества, г/моль.
Понятие эквивалента введено в химию для сопоставления соединительной способности различных элементов.
Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Эквивалентной массой (mэкв) называется масса 1 эквивалента вещества.
Например: в соединениях HBr, H2O, NH3 с 1 молем атомов водорода соединяется соответственно 1 моль брома, 1/2 моля атомов кислорода и 1/3 атомов азота.
Следовательно, эквиваленты брома, кислорода и азота равны соответственно 1 молю, 1/2 и 1/3 моля. Исходя из мольных масс атомов этих элементов, находим, что эквивалентная масса брома равна 79,9 г/моль, кислорода - 16*1/2= г/моль, азота - 14*1/3=4,67 г/моль.
Эквивалентную массу можно определить по химической формуле химического соединения
m жа(оксида) = М оксида/(число атомов кислорода*2);
m экв(основания) = М основания/кислотность основания;
m экв(кислоты) = М кислоты/основность кислоты;
m экв(соли) = М соли /(число атомов металла*валентность металла).
Основность кислоты определяется числом протонов, которое отдает молекула кислоты, реагируя с основанием; кислотность основания определяется числом протонов, присоединяемых молекулой основания при взаимодействии его с кислотой.
Например:
М экв СО2=44 г/моль /1*4=44/4=11 г/моль;
М экв H2SO4=98 г/моль/2=46 г/моль;
М экв NaOH=40 г/моль/1=40 г/моль;
М экв СаСО3=100 г/моль/1*2=50 г/моль.
При решении некоторых задач, содержащих сведения об объемах газообразных участников реакции, целесообразно пользоваться значением эквивалентного объема.
Эквивалентным объемом называется объем, занимаемый при данных условиях 1 эквивалентном вещества. Значение эквивалентного объема вещества, находящегося в газообразном состоянии, можно найти, зная, что в мольном объеме любого газа, состоящего из одноатомных молекул, содержится 1 моль атомов, состоящего из двухатомных молекул - 2 моля атомов и т.д. Так, в 22,4 л Н2 содержится при нормальных условиях 2 моля атомов водорода. Так как эквивалент водорода равен 1 моль, то в 22,4 л Н2 содержатся 2 эквивалента водорода; значит, эквивалентный объем водорода равен 22,4/2=11,2 л/моль.
Наиболее важным законом химии является закон эквивалентов: химические элементы соединяются друг с другом в строго определенных количествах, соответствующих их эквивалентам. Математическое выражение закона эквивалентов имеет следующий вид: 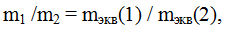 где m1 и m2 - массы реагирующих или образующихся веществ, m экв(1) и m экв(2) - эквивалентные массы этих веществ.
где m1 и m2 - массы реагирующих или образующихся веществ, m экв(1) и m экв(2) - эквивалентные массы этих веществ.
Например: некоторое количество металла, эквивалентная масса которого равна 28г/моль, вытесняет из кислоты 0,7 л водорода, измеренного при нормальных условиях. Определить массу металла.
Решение: зная, что эквивалентный объем водорода равен 11,2 л/моль, составляет пропорцию:
28 г металла эквивалентны 11,2 л водорода
х г металла эквивалентны 0,7 л водорода.
Тогда х=0,7*28/11,2= 1,75 г.
Для определения эквивалента или эквивалентной массы необязательно исходить из его соединения с водородом. Их можно определить по составу соединения данного элемента с любым другим, эквивалент которого известен.
Например: при соединении 5,6 г железа с серой образовалось 8,8 г сульфида железа. Нужно найти эквивалентную массу железа и его эквивалент, если известно, что эквивалентная масса серы равна 16 г/моль.
Решение: из условия задачи следует, что в сульфиде железа на 5,6 г железа приходится 8,8-5,6=3,2 г серы. Согласно закону эквивалентов, массы взаимодействующих веществ пропорциональны их эквивалентным массам, то есть
5,6 г железа эквивалентны 3,2 г серы
mэкв (Fе) эквивалентна 16 г/моль серы.
Отсюда следует, что m3KB(Fe) = 5,6*16/3,2=28 г/моль. Эквивалент железа равен: 3=mэкв(Fe)/M(Fe)=28 г/моль:56 г/моль=1/2. Следовательно, эквивалент железа равен 1/2 моля, то есть в 1 моле железа содержится 2 эквивалента.
Основные законы химии. Стехиометрические законы.
В 1756 г. на основе проводимых исследований М.В. Ломоносов пришел к выводу о неизменности веса веществ при химических превращениях и вывел закон сохранения вещества при протекании химических реакций: вес всех веществ, вступающих в химическую реакцию, равен весу всех продуктов реакции.
Закон сохранения вещества можно заменить эквивалентным ему законом сохранения массы: масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Например: в химической реакции: С+О2=СО2 масса веществ, вступивших в реакцию, равна
М(С) + М(О2)=12 г/моль+2* 16=32 г/моль=44 г/моль, а масса продукта реакции равна М(СО2)=12+2*16=44 г/моль.
Другим основным законом химии является закон постоянства состава, открытый Прустом в 1801 году. Он формулируется следующим образом: каждое химическое соединение независимо от способа его получения имеет определенный состав.
Например: оксид углерода можно получить по любой из этих реакций
С+О2=СО2,
2СО+О2=2СО2
СаСО3=СаО+СО2
NaHCO3+HCl=NaCl+H2O+CO2,
но в чистом оксиде углерода независимо от способа получения всегда содержится 27,29 мас.% С и 72,71 мас.% О.
Таким образом, закон постоянства состава утверждает количественную определенность каждого химического соединения. Следует отметить, что обратное утверждение - каждому определенному составу отвечает только одно химическое соединение - неверно. Например: диметиловый эфир и этиловый спирт имеют одинаковый химический состав - С2Н6О , но являются различными химическими соединениями: СН3-О-СН3 и С2Н5ОН.
Основные газовые законы.
Состояние газа характеризуется его температурой, давлением и объемом. Если температура газа равна О°С, а давление равно нормальному атмосферному (101,325 Па или 760 мм рт. ст.), то условия, при которых находится газ, называют нормальными. Объем, занимаемый газом при этих условиях, принято обозначать через Vo, а давление - через Ро.
Закон Гей-Люссака: объемы вступающих в реакцию газов относятся к друг другу, а также к объему получающихся газообразных продуктов, как простые целые числа.
Рассмотрим реакции:
Н2+С12=2НС1
2Н2+О2=2Н2О
3H,+N2=2NH3.
Из данных химических реакций видно, что если смешать равные объемы хлора и водорода и выставить на солнечный свет, то происходит взрыв и образуется новое газообразное вещество - хлористый водород. Оба газа соединяются без остатка, если на 1 объем хлора приходится 1 объем водорода, причем получаются ровно 2 объема хлористого водорода. Аналогично, и при других реакциях наблюдается та же закономерность, что в первой реакции: при взаимодействии газообразных химических соединений между объемами реагирующих и образующихся веществ существуют простые соотношения.
Из закона Гей-Люссака следует, что при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре (Т, К):
V1,T1 =V2/T2 или V/T=const
Пример: при 27°С объем газа равен 600мл, Какой объем займет газ при 57°С, если давление будет оставаться постоянным?
Решение: обозначим искомый объем через V2, а соответствующую ему температуру через Т2. По условию задачи V1=600мл, Т1=273+27=300К и Т2=273+57=330К. Подставляя эти значения в математическое выражение закона Гей-Люссака, получим: 600/300=V2/330, откуда V2=600*330/300=660 мл.
Кроме того, при постоянном объеме давление газа изменяется прямо пропорционально абсолютной температуре: P1/T1=P2/T2.
Пример: при 15°С давление в баллоне с кислородом равно 91,2*102кПа. При какой температуре оно станет равным 101,3*102 кПа?
Решение: обозначим искомую температуру как Т2. По условию задачи T1=273+15=288K, P1=91,2 102 кПа. Подставляя эти значения в уравнение, находим, что Т2=101,3102*288/(91,2*102)=320К или 47°С.
Исследования Гей-Люссака привлекли в себе внимание химиков. Простота отношений между объемами реагирующих газов показала, что здесь проявляется какое-то основное свойство газов, выражающееся также в их одинаковом поведении при изменениях давления и температуры.
Проанализировав исходные данные, Авогадро сформулировал в 1811г. закон (закон Авогадро): в равных объемах любых газов, взятых при одинаковой температуре и одинаковом давлении, содержится одинаковое число молекул. При нормальных условиях один моль любого газа занимает объем, равный 22,4 л.
Отсюда можно заключить, что моль любого, вещества имеет одинаковое число молекул. Это число называется числом Авогадро.
Объем 22,4 л называют молярным (мольным) объемом газа и обозначают соответственно VM = 22,4 л/моль.
Например, рассмотрим оксид серы SO2. Молекулярная масса M(SO2) равна 64 г/моль. Значит, один моль SO2 имеет массу 64 г и занимает объем (при н.у.), равный 22,4л, а также содержит в этом объеме 6,02*1023 молекул этого газа.
Связь между массой m и объемом V газа при н.у. определяется формулой m = n*M = (V/VM)M:
Закон Бойля-Мариотта: при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объему газа.
Математическим выражением закона Бойля-Мариотта являются формулы P2/P1=V1/V2 или PV=const.
Пример: при некоторой температуре давление газа, занимающего объем 3 л, равно 93,3 кПа. Каким станет давление, если, не изменяя температуры, уменьшить объем газа до 2,8л?
Решение: обозначив искомое давление через Р2, можно записать
Р2/93,3=3/2,8. Отсюда: Р2=93,3*3/2,8=100 кПа.
Зависимость между объемом газа, давлением и температурой можно выразить общим уравнением, объединяющим законы Бойля-Мариотта и Гей-Люссака
PV/T=P0Vo/To,
где Р и V - давление и объем газа при данной температуре Т, Ро, Vo - давление и объем газа при нормальных условиях.
Пример: при 25°С и давлении 99,3 кПа некоторое количество газа занимает объем 152 мл. Найти, какой объем займет это же количество газа при 0°С и давлении 101,33 кПа?
Решение: подставляя данные в уравнение, получаем
Vо=РVоТ/Р0Т=99,ЗкПа*152мл*273К/(101,33кПа*298К)=136,5мл.
Если условия, в которых находится газ, отличаются от нормальных, то используют уравнение Менделеева-Клапейрона, которое связывает все основные параметры газа
PV = (m/M)RT,
где Р - давление газа, Па; V - объем газа, м3; m, - масса газа, г; М - мольная масса газа, г/моль; R - универсальная газовая постоянная, 11=8,31Дж/(моль*К); Т - температура газа, К.
При определении молекулярных весов газообразных веществ часто приходится измерять объем газа, собранный над водой и потому насыщенного водяным паром. Определяя в этом случае давление газа, необходимо вводить поправку на парциальное давление водяного пара.
Парциальным давлением (р) называется та часть общего давления, производимого газовой смесью, которая приходится на долю данного газа.
При этом парциальное давление газа в смеси равно тому давлению, которое он производил бы, занимая один такой же объем, какой занимает смесь.
Пример: смешивают 2л кислорода и 4л оксида серы SO2 , взятых при одинаковом давлении, равном 100 кПа; объем смеси 6л. Определить парциальное давление газов в смеси.
Решение: по условию задачи объем кислорода увеличился после смешения в 6/2=3 раза, объем оксида серы - в 6/4=1,5 раза. Во столько же раз уменьшились парциальные давления газов. Следовательно
р(О2)= 100/3=33,3 кПа, p(SO2)=100/l,5=66,7 кПа.
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих смесь.
Пример: смешивают Зл СО2, 4л О2 и 6 л N2. До смешивания давление СО2, О2, N2.составляло соответственно 96, 108 и 90,6 кПа. Общий объем смеси 10л. Определить давление смеси.
Решение: находим парциальные давления отдельных газов
р(СО2)=96*3/10=28,8кПа,
р(О2)=108*4/10=43,2кПа,
p(N2)=90,6*6/l 0=54,4кПа.
Общее давление газовой смеси равно сумме парциальных давлений
Р(смеси)=28,8кПа+43,2кПа+54,4кПа=126,4 кПа.