Изопроцессы. Адиабатный процесс. Политропный процесс
1. Изотермический процесс. Изменение внутренней энергии при изотермическом процессе не происходит. Все количество теплоты, переданное системе, согласно формуле (48), идет на совершение работы: ΔQ=A.

Рис. 12 Изотермический процесс (изотерма)
Полная работа A, совершаемая газом при изменении его объема от V1 до V2:
2. Изобарный процесс - процесс, протекающий при постоянном давлении. Первое начало термодинамики для изобарного процесса:

Рис. 13 Изобарный процесс (изобара)
3. Изохорный процесс. При изохорном процессе газ не совершает работы. Первое начало термодинамики для изохорного процесса: ΔQ=ΔU.

Рис. 14 Изохорный процесс (изохора)
Изменение внутренней энергии системы при изохорном процессе:
4. Адиабатический процесс - процесс, при котором отсутствует теплообмен между системой и окружающей средой (ΔQ=0). Все быстропротекающие процессы можно отнести к адиабатическим.
Уравнения состояний системы для адиабатического процесса:
Диаграмма адиабатического процесса (адиабата) в координатах (p,V) изображается более крутой гиперболой, чем изотерма (рис. 15). Это объясняется тем, что при адиабатическом сжатии увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры. Первое начало термодинамики для адиабатического процесса (внешняя работа совершается за счет изменения внутренней энергии системы):

Рис. 15. Адиабатный процесс (адиабата)
5. Политропический процесс – процесс, в котором теплоемкость остается постоянной:
где n - показатель политропы.
Из уравнения политропы получаются уравнения рассмотренных выше процессов:
Изобарный процесс: n=0, P=const.
Изотермический процесс: n=1, PV=const.
Адиабатный процесс: n=λ, PVλ=const.
Изохорный процесс: n=±∞, PVn=const.

Рис. 12 Изотермический процесс (изотерма)
Полная работа A, совершаемая газом при изменении его объема от V1 до V2:
A=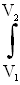 PdV=
PdV=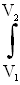 (m/M)·RT·dV/V=(mRT/M)·ln(V2/V1)=(mRT/M)·ln(P1/P2). (58)
(m/M)·RT·dV/V=(mRT/M)·ln(V2/V1)=(mRT/M)·ln(P1/P2). (58)
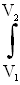 PdV=
PdV=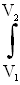 (m/M)·RT·dV/V=(mRT/M)·ln(V2/V1)=(mRT/M)·ln(P1/P2). (58)
(m/M)·RT·dV/V=(mRT/M)·ln(V2/V1)=(mRT/M)·ln(P1/P2). (58)2. Изобарный процесс - процесс, протекающий при постоянном давлении. Первое начало термодинамики для изобарного процесса:

Рис. 13 Изобарный процесс (изобара)
ΔQ=Сv·(m/M)·RΔT+PΔV=Сp(m/M)ΔT. (59)
3. Изохорный процесс. При изохорном процессе газ не совершает работы. Первое начало термодинамики для изохорного процесса: ΔQ=ΔU.

Рис. 14 Изохорный процесс (изохора)
Изменение внутренней энергии системы при изохорном процессе:
ΔU=mCvΔT/M (60)
4. Адиабатический процесс - процесс, при котором отсутствует теплообмен между системой и окружающей средой (ΔQ=0). Все быстропротекающие процессы можно отнести к адиабатическим.
Уравнения состояний системы для адиабатического процесса:
PVλ=const - уравнение Пуассона, (61)
TVλ-1=const, TλPλ-1=const.
Диаграмма адиабатического процесса (адиабата) в координатах (p,V) изображается более крутой гиперболой, чем изотерма (рис. 15). Это объясняется тем, что при адиабатическом сжатии увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры. Первое начало термодинамики для адиабатического процесса (внешняя работа совершается за счет изменения внутренней энергии системы):

Рис. 15. Адиабатный процесс (адиабата)
A=-ΔU, или PΔV=-mCvΔT/M. (62)
5. Политропический процесс – процесс, в котором теплоемкость остается постоянной:
PVn=const, (63)
где n - показатель политропы.
n=(C-Cp)/(C-Cv)
Из уравнения политропы получаются уравнения рассмотренных выше процессов:
Изобарный процесс: n=0, P=const.
Изотермический процесс: n=1, PV=const.
Адиабатный процесс: n=λ, PVλ=const.
Изохорный процесс: n=±∞, PVn=const.
Поиск на сайте
