Валентность и валентные электроны.
Валентность элемента определяется числом электронов, участвующих в образовании химических связей.
Понятие о валентности прочно вошло в науку к середине прошлого столетия. Основываясь на существовании валентных связей, А. М. Бутлеров (1862г.) построил теорию химического строения. Эта теория создавалась в первую очередь применительно к органическим соединениям, так как в них наиболее ярко выражена зависимость свойств веществ не только от состава, но и от строения их молекул.
Причиной всех реакций, в которые вступает вещество, А. М. Бутлеров считал его химическое строение — последовательность связи атомов в молекуле, характер их взаимодействия и взаимного влияния.
Изучение природы валентности, природы химической связи привело к разделению понятия о валентности на ряд новых более конкретных понятий: ковалентность, ионная валентность, координационное число, степень окисления (окисли¬тельное число).
Химические свойства элементов определяются структурой наружных электронных слоев атомов. Химическая реакция сводится к взаимодействию валентных электронов атомов, участвующих в реакции. Поэтому в зависимости от строения атомов характер взаимодействия может быть различным. Таким образом, вид связи между атомами определяется их строением.
Природу химической связи удалось несколько раскрыть с появлением квантовой механики, учитывающей волновые свойства электрона.
Квантово-механические расчеты показывают, что взаимодействовать могут только атомы, у которых имеются неспаренные электроны. Число неспаренных электронов определяет валентность атома того или иного элемента. Валентные электроны у атомов элементов главных подгрупп периодической системы находятся на внешнем энергетическом уровне (s и p подуровнях), У ЭЛЕМЕНТОВ Побочных подгрупп – кроме того на d-подуровне пред внешнего уровня. У атомов лантаноидов и актиноидов валентными могут быть также f-электроны третьего снаружи энергетического уровня. Валентность элементов не всегда совпадает с числом не¬спаренных электронов. Например, у атома серы имеется два неспаренных электрона. В соответствии с этим сера дает соединения, в которых она двухвалентна, но известны соединения, в которых валентность серы равна четырем и даже шести. Повышение валентности серы с связано с увеличением числа неспаренных электронов, образующихся в результате возбуждения атома и перехода одного из спаренных электронов на ближайший подуровень того же энергетического уровня. Переход р-электрона из одного состояния в другое увеличивает число неспаренных электронов на два, следовательно, валентность атома увеличивается на две единицы; переход одного s-электрона приводит к увеличению валентности еще на две единицы. Таким образом, максимальная валентность атомов многих элементов достигается лишь в возбужденном состоянии. В зависимости от степени возбуждения атома число неспаренных электронов может быть различным, поэтому многие элементы проявляют переменную валентность.
Ковалентная или атомная связь.
Образование связи между двумя атомами происходит при сближении атомов с неспаренными электронами, спины которых антипараллельны. В результате взаимодействия электронов и ядер атомов образуется пара электронов, общая для обоих соединяющихся атомов. Возникает единое электронное облако, плотность которого между ядрами особенно велика, что обеспечивает наибольшее притяжение атомных ядер друг к другу и устойчивость молекулы в целом. Связь, возникающая за счет образования одной или нескольких электронных пар, которые становятся общими для двух соединяющихся атомов, называется ковалентной связью.
Образование связи сопровождается выделением энергии, которая в расчете на моль вещества называется энергией связи. Чтобы разорвать связь между атомами, необходимо затратить количество энергии, равное энергии связи. Суммарная энергия свободных атомов больше, чем энергия молекулы, из них образующейся.
Изменение энергии системы, состоящей из двух атомов, в зависимости от расстояния между ними можно иллюстрировать графиком потенциальной кривой молекулы водорода. За нуль принимают потенциальную энергию сближающихся атомов при расстоянии равном бесконечности. Следовательно, в этих условиях энергия их взаимодействия равна нулю. На рисунке по вертикальной оси отложены значения этой энергии, по горизонталь¬ной — расстояния между ядрами атомов. В точке О находится один атом водорода, к нему движется по горизонтальной прямой другой атом. При сближении атомов возникают силы кулоновского притяжения между ядром первого атома и электроном второго, а также между ядром второго и электроном первого, и энергия системы убывает. При дальнейшем уменьшении расстояния наряду с силами притяжения действуют и силы отталкивания между ядрами и между электронами. На расстоянии 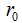 силы притяжения уравновешивают силы отталкивания. Это равновесное расстояние (
силы притяжения уравновешивают силы отталкивания. Это равновесное расстояние (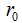 ), которому соответствует минимум энергии системы, называют длиной связи, или межъядерным расстоянием. При дальнейшем уменьшении r начинают преобладать силы отталкивания над силами притяжения и атомы расходятся, энергия системы резко возрастает. Для молекулы водорода длина связи составляет
), которому соответствует минимум энергии системы, называют длиной связи, или межъядерным расстоянием. При дальнейшем уменьшении r начинают преобладать силы отталкивания над силами притяжения и атомы расходятся, энергия системы резко возрастает. Для молекулы водорода длина связи составляет 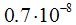 кдж/моль.
кдж/моль.
Ковалентную связь можно рассматривать как взаимодействие электронов и ядер атомов, которое осуществляется благодаря волновым свойствам электронов, движущихся в пространстве между ядрами.
Условно образование связи можно представить как соединение двух электронов в одной молекулярной энергетической ячейке, энергетический уровень которой ниже, чем исходных атомных энергетических ячеек.
В молекулах газообразных веществ, таких как Н2, N2, С12, атомы соединены ковалентной связью. В образовании этой связи участвуют неспаренные электроны внешнего энергетического уровня. Схематично атом изображают символом эле¬мента и около него ставят точки, число которых должно соответствовать числу наружных электронов.
Например: 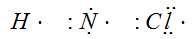
При взаимодействии двух атомов водорода между ними образуется одна общая электронная пара: 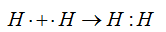
У каждого из соединяющихся атомов хлора имеется по од¬ному неспаренному электрону, при взаимодействии которых возникает общая электронная пара. Образование молекулы хлора можно представить схемой: 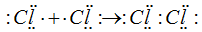
В молекуле хлора каждому атому соответствуют 8 электронов внешнего слоя. Отмечено, что устойчивые молекулы и сложные ионы имеют такое строение, при котором каждый атом достигает электронной конфигурации инертного элемента (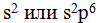 ). Эту часто наблюдаемую закономерность называют правилом октета. Между атомами может быть не только одна, но и две и три общие электронные пары. Так, атомов азота имеются три неспаренных электрона, поэтому атомы соединяются друг с другом тремя электронными парами
). Эту часто наблюдаемую закономерность называют правилом октета. Между атомами может быть не только одна, но и две и три общие электронные пары. Так, атомов азота имеются три неспаренных электрона, поэтому атомы соединяются друг с другом тремя электронными парами 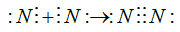
Эти электронные пары являются общими для обоих атомов, поэтому каждый атом азота имеет во внешнем слое 8 электронов.
Валентность элемента в соединении с ковалентной связью определяется числом неспаренных электронов, участвующих в образований общих электронных пар. Например, структурная формула имеет вид: 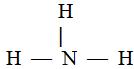
Насыщаемость. Молекула водорода Н2, образованная двумя атомами, не может присоединить еще атом водорода, так как валентные силы взаимно насыщены. Не присоединяют атомов водорода или другого элемента и некоторые более сложные молекулы, например, молекулы метана, в которых насыщены все четыре валентности углерода и валентности четырех атомов водорода. Очевидно, если бы не было насыщаемости ковалентной связи, то элементы не обладали бы целочисленными значениями валентности.
Направленность. Ковалентным связям присуще определенное пространственное направление относительно друг друга. Две связи могут быть вытянуты в одну линию или могут образовать между собой некоторый угол. Например, в молекуле Н2О две связи, Н — О образуют угол равный 104,50°.
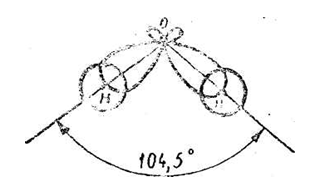
Схема образования единого электронного облака молекулы воды
В образований связей участвуют s-электроны водорода, облака которых имеют шаровую симметрию, т. е. полностью лишены направленности, и р-электроны кислорода, форма облаков которых напоминает перетянутый посередине эллипсоид вращения s-р-связи образуются в направлении наибольшего перекрывания электронных облаков — по оси симметрии облаков р-электронов. В результате этого возникает общее электронное облако молекулы воды.
В молекуле NH3 в образовании связей электрона азота и три р-электрона водорода. Молекула аммиака имеет форму треугольной пирамиды. Опыт показывает, что образующиеся связи находятся под углом друг к другу, равным 107°.
Из квантово-механического расчета следует, что если в атоме имеются два или три 2р-электрона, то их облака направлены под прямым углом друг к другу. Учитывая, что облака s-электронов не имеют направленности, можно сделать вывод о том, что в молекулах воды и аммиака s-p-связи должны быть направлены под прямом углом. Однако эти углы различны и больше 900. Отклонение расчетных данных от опытных объясняют смешиванием и выравниванием электронных облаков, в результате чего возникает новое облако связи, поэтому истинный угол между связями не соответствует расчетному. Такие связи называются гибридными. Своеобразная перестройка формы электронного облака называется гибридизацией.
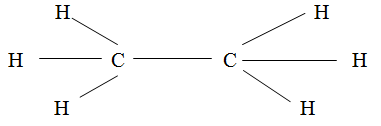
Электронная формула возбужденного атома углерода 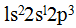 . В молекуле метана химические связи между атомом углерода и атомами водорода образуются за счет трех р-электронов и одного s-электрона атома углерода и четырех s-электронов атомов водорода. Но при образовании связей происходит их гибридизация, что ведет к образованию равноценных и прочных связей. Новые связи не являются s-p- или s-s-связями, а представляют гибриды тех и других. Гибридные связи направлены под одинаковыми углами 109°28', поэтому молекула метана имеет форму тетраэдра.
. В молекуле метана химические связи между атомом углерода и атомами водорода образуются за счет трех р-электронов и одного s-электрона атома углерода и четырех s-электронов атомов водорода. Но при образовании связей происходит их гибридизация, что ведет к образованию равноценных и прочных связей. Новые связи не являются s-p- или s-s-связями, а представляют гибриды тех и других. Гибридные связи направлены под одинаковыми углами 109°28', поэтому молекула метана имеет форму тетраэдра.

Схематическое изображение облаков σ-связи (горизонтальной линией обозначена ось симметрии).
В σ- и 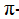 связи. Ковалентная связь может возникнуть в результате наложения облаков; либо s и s-, либо s и р-, либо р и р электронов, причем наибольшая плотность облака достигается между ядрами атомов по оси симметрии облака (линии, соединяющей ядра). Такую ковалентную связь называют сигма-связью и обозначают греческой буквой σ.
связи. Ковалентная связь может возникнуть в результате наложения облаков; либо s и s-, либо s и р-, либо р и р электронов, причем наибольшая плотность облака достигается между ядрами атомов по оси симметрии облака (линии, соединяющей ядра). Такую ковалентную связь называют сигма-связью и обозначают греческой буквой σ.
В молекуле этана семь σ-связей.
В тех случаях, когда между двумя атомами возникают две или три ковалентные связи, при образовании второй и третьей связи возможно частичное перекрывание облаков двух р- или d-электронов. В этом случае образуются связи отличные от σ-СВЯЗИ. Например, в молекуле этилена С2Н4 только одна связь между атомами углерода имеет максимальную плотность облака по оси симметрии, т. е. является σ-связью. Вторая связь между атомами углерода возникает в результате частичного перекрывания своими боковыми частями облаков р-электронов. Такая связь называется (пи)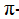 связью.
связью.
При соединении атомов, имеющих различные значения электроотрицательности, возникает ковалентная полярная связь. В этом случае общая электронная пара смещена в сторону ядра того атома, у которого электроотрицательность больше. Например, в молекуле хлористого водорода общая электронная пара смещена к ядру атома хлора, электронное облако неравномерно распределено в поле обоих ядер. В результате электрические центры положительных и отрицательных зарядов обоих атомов не совпадают в одной точке, что ведет к полярности связи.
Полярность связи характеризуют дипольным моментом μ, который равен произведению заряда электрона е на расстояние l между электрическими центрами положительных и отрицательных зарядов: 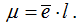 Дипольный момент выражают в дебаях D. Так как
Дипольный момент выражают в дебаях D. Так как 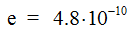 , а l имеет величину порядка расстояния между ядрами в молекуле 10^-8 см, то D=10^-18 эл. сm. ед. см . Дипольный момент есть величина направленная — вектор; его изображают стрелкой, имеющей направление от минуса к плюсу.
, а l имеет величину порядка расстояния между ядрами в молекуле 10^-8 см, то D=10^-18 эл. сm. ед. см . Дипольный момент есть величина направленная — вектор; его изображают стрелкой, имеющей направление от минуса к плюсу.
Чем больше различаются электроотрицательности двух атомов, образующих молекулу, тем больше дипольный момент связи, тем больше ее полярность.
Если элементы очень сильно различаются по своим химическим свойствам, то электронная пара может полностью переместиться в поле ядра того атома, который характеризуется большей величиной электроотрицательности. В результате перемещения электронной пары возникают за¬ряженные частицы — ионы, одни из которых, имеют положительный заряд, другие — отрицательный. Разноименно заряженные ионы стягиваются друг с другом за счет сил электростатического притяжения. Возникшую связь называют ионной или электровалентной.
Ионная связь качественно отлична от ковалентной и менее распространена, так как она образуется между атомами эле¬ментов резко различных по своему химическому характеру, например, между атомами щелочных металлов и галогенов. В отличие от ковалентной связи ионная связь не обладает насыщаемостью. Так, в кристалле поваренной соли каждый ион натрия 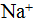 взаимодействует с шестью ионами хлора
взаимодействует с шестью ионами хлора 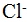 .
.
Валентность элементов в ионных соединениях может быть положительной и отрицательной. При образовании окиси кальция СаО два s-электрона атома кальция и два р-электрона атома кислорода участвуют в образовании двух электронных пар, которые полностью перемещаются, в поле ядра атома кислорода. В результате образуются ионы 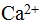 и
и 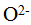 , которые электростатически притягиваются друг к другу, образуя СаО. В этом соединении ион кальция имеет положительную валентность, равную двум, а ион кислорода — отрицательную, также разную двум. Каждый из ионов, образующих кристалл СаО, имеет устойчивую структуру внешнего электронного слоя (октет). Прочность ионных связей определяется стабильностью таких электронных конфигураций.
, которые электростатически притягиваются друг к другу, образуя СаО. В этом соединении ион кальция имеет положительную валентность, равную двум, а ион кислорода — отрицательную, также разную двум. Каждый из ионов, образующих кристалл СаО, имеет устойчивую структуру внешнего электронного слоя (октет). Прочность ионных связей определяется стабильностью таких электронных конфигураций.
Кроме ионов, обладающих электронной структурой инертного элемента, имеются ноны с иной структурой; они устой¬чивы даже в водных растворах. Такие ионы образуют металлы, атомы которых имеют валентные d-электроны: марганец, кобальт, никель и другие. Для этих ионов характерным является различная устойчивость. Например, ион 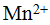 более устойчив, чем ион
более устойчив, чем ион 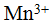 , ионы
, ионы 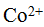 и
и 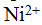 более устойчивы, чем соответствующие им трех зарядные ионы.
более устойчивы, чем соответствующие им трех зарядные ионы.
Понятие о положительной и отрицательной валентности элементов, образующих ковалентные соединения, не имеет смысла, так как в этих соединениях нет ионов. Поэтому в настоящее время пользуются представлением о степени окисления или окислительном числе. В ионном соединении степень окисления иона равна его заряду. В соединении с ковалентными связями степень окисления атома определяется числом электронов, участвующих в образовании связи, и его электроотрицательностью. Например, степень окисления азота в аммиаке равна 3—, так как три электрона от атомов водорода смещены к более электроотрицательному атому азота; степень окисления водорода равна 1+. Степень окисления кислорода обычно равна 2—. Исходя из этого легко определить степень окисления другого элемента с ним связанного. Исключением является соединение F2O, в котором степень окисления кисло¬рода равна 2+, так как фтор самый электроотрицательный элемент и степень окисления его всегда равна 1—. Степень окисления водорода, как правило, равна 1 +. Исключение составляет степень окисления водорода в гидридах (NаН, СаН2), в которых она равна 1 —.
Зная степень окисления одного элемента, легко установить степень окисления другого, так как сумма степеней окисления атомов, образующих молекулу, равна нулю.
Характер химических связей оказывает существенное влияние на свойства веществ. Так, вещества с ионными связями в молекулах, как правило, имеют более высокие температуры кипения и плавления, чем вещества, состоящие из молекул с неполярными ковалентными связями. Промежуточное положение по свойствам занимают вещества, в молекулах которых атомы соединены ковалентной полярной связью. Например:
| Наименование вещества | Фтористый натрий | Фтористый водород | Фтор |
| Характер связи | Ионная | Ковалентная полярная | Ковалентная неполярная |
| Температура плавления в С | 995 | -92 | -223 |
Ионная и ковалентная связи – это крайние случаи реальных связей. В молекулах имеют место различные виды взаимодействия; даже в одной и той же молекуле атомы соединены чисто различными связями.
Химическая связь может возникнуть не только между свободными атомами, но и между валентно-насыщенными молекулами. Примером может служить образование молекулы хлористого аммония:
NH3+HC1 = NH4C1.
Молекулы аммиака и хлористого водорода электронейтральны и неспаренных электронов не имеют. У атома азота в NH3 имеются четыре пары электронов, из которых одна является неподеленной парой, т. е. принадлежащей только атому азота. За счет этой пары электронов и возникает связь с ионом водорода, образующимся из молекулы HCl:
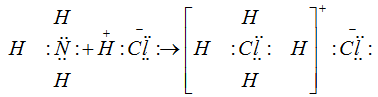
Новая связь по своим свойствам ничем не отличается от других ковалентных связей между азотом и водородом. В результате гибридизации все связи в ионе аммония равноценны.
Ковалентная связь, образовавшаяся за счет неподеленной пары электронов, называется координационной или донорно-акцепторной связью. Атом или ион, предоставляющий неподеленную пару электронов, называется донором. Атом или ион, соединяющийся с донором, называется акцептором.
В образовании координационной связи наряду с s- и р могут участвовать и d-электроны. Причем эта связь может возникнуть не только при взаимодействии нейтральных молекул, но и при взаимодействии ионов с молекулами или ионов с ионами. Координационная связь характерна для комплексных соединений. Например, ионы цинка при взаимодействии с молекулами аммиака образуют комплексные ионы состава: 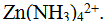 Число молекул аммиака, входящих в состав этого иона, всегда одинаково и равно четырем. Его называют координационным числом. Связь между ионом цинка и молекулами аммиака образуется за счет неподеленной пары электронов атома азота.
Число молекул аммиака, входящих в состав этого иона, всегда одинаково и равно четырем. Его называют координационным числом. Связь между ионом цинка и молекулами аммиака образуется за счет неподеленной пары электронов атома азота.
Водород, входящий в состав одной, молекулы воды, соединяется с кислородом другой молекулы воды:
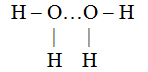
Показанная пунктиром дополнительная связь называется во¬дородной. Она может возникнуть между молекулами, в которых водород соединен с элементами, обладающими большой величиной электроотрицательности, такими как кислород, фтор, азот. Подобно воде за счет водородных связей могут соединяться друг с другом молекулы фтористого водорода:
Водородная связь значительно менее прочна, чем обычная химическая связь. Энергия водородной связи составляет 5—7 ккал/моль (21—29 кдж/моль), в то время как энергия ковалентной связи —30105 ккал/моль (125—420 кдж/моль).
Водородная связь влияет на многие свойства веществ, т. к. возникновение ее может быть причиной ассоциации (объединения) молекул. Так, вода имеет более высокие температуры плавления и кипения по сравнению с другими соединениями такого же типа, например H2S. Аномальные свойства воды объясняют ассоциацией ее молекул. Фтористый водо¬род имеет температуру кипения +20° С, а его аналог, хлористый водород, у которого водородные связи отсутствуют, кипит при —84° С; у фтористого водорода молекулы ассоциированы.
Способность водорода давать дополнительную связь можно объяснить его малой электроотрицательностью и малыми размерами атомов. Большая полярность химической связи между атомами водорода и атомами кислорода, фтора и азота позволяет рассматривать водород как положительно заряженный ион
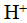 . Этот ион не имеет электронной оболочки, поэтому активно взаимодействует с другими атомами или ионами.
. Этот ион не имеет электронной оболочки, поэтому активно взаимодействует с другими атомами или ионами. Молекулы некоторых веществ вне зависимости от внешнего электрического поля представляют собой диполи, т. е. системы, имеющие два равных по величине, но противоположных по знаку электрических заряда. Такие молекулы называют полярными.
Если в двухатомных молекулах сложных веществ связь между различными атомами полярна, то и сами молекулы обладают постоянным дипольным моментом.Дипольный момент таких молекул совпадает по направлению и величине с дипольным моментом связи. Примером может служить молекула НСl, в которой электронное облако смещено к хлору, следовательно, центр отрицательных зарядов лежит ближе к атому хлора, а центр положительных — к атому водорода.
В молекулах простых веществ типа Н2, Cl2, N2 связь неполярна, дипольный момент их равен нулю. Такие молекулы называют неполярными.
Неполярными являются и многие симметрично построенные молекулы сложных веществ. Например, молекулы двуокиси углерода СО2, сероуглерода CS2, четыреххлористого углерода СС14 неполярны, в то время как связи между атомами в них полярны. Причина этого кроется в направленности связей, в величине и направленности дипольных моментов этих связей.
Чтобы рассчитать дипольный момент многоатомной молекулы, можно приближенно рассмотреть каждую валентную связь в такой молекуле как независимую от других и характеризовать значением свойственного ей дипольного момента. В этом случае дипольный момент молекулы будет равен векторной сумме дипольных моментов отдельных связей.
Молекула СО2 имеет симметричное линейное строение, так как угол между направлениями связей составляет 180° С. Дипольные моменты двух отдельных связей
С = О равны по величине и противоположно направлены, поэтому результирующий дипольный момент молекулы СО2 равен нулю. Подобное строение имеют молекулы CS2.
Молекула СС14 имеет симметричное тетраэдрическое строение, постоянный дипольный момент ее также равен нулю. Напротив, дипольный момент молекулы воды отличен от нуля. В молекуле воды угол, между направлениями двух связей О — Н равен 104,5°, поэтому суммарный дипольный момент направлен по диагонали параллелограмма и равен 1,84 D.
Дипольный момент молекулы зависит от природы связей, от их пространственного расположения и взаимодействия. В свою очередь величина и направление дипольного момента раскрывают строение молекулы, характеризуют степень полярности связей и взаимное влияние атомов и связей.
Поляризация молекул, атомов, ионов.
Важной величиной, от которой зависит целый ряд свойств молекул и атомов, является их поляризуемость. Поляризация заключается в деформации электронных оболочек, т. е. в смещении электронов относительно ядра атома под влиянием внешнего электрического поля.
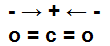
Строение молекулы двуокиси углерода.
Поляризуются как полярные, так и неполярные молекулы, но поляризация у них происходит по-разному. В неполярной молекуле (или атоме) в электрическом поле происходит деформация электронного облака, центры отрицательных и положительных зарядов расходятся и возникает диполь. Такой диполь характеризуют индуцированным дипольным моментом. Oн равен произведению заряда электрона е на расстояние /, на которое раздвигаются центры положительных и отрицательных зарядов. В отсутствии внеш¬него поля /=0 и, следовательно, дипольный момент также равен нулю.
У веществ, молекулы которых являются постоянными диполями, под влиянием электрического поля происходит ориентационная поляризация. Полярные молекулы ориентируются электрическим полем так, чтобы дипольный момент молекул был направлен вдоль поля. В результате создается дополнительная поляризация молекул и длина диполя увеличивается.
Ионы, подобно электрическому полю, оказывают поляризующее действие друг на друга. При встрече двух ионов происходит их взаимная поляризация, т.е. смещение электронов внешних слоев относительно ядер. Взаимная поляризация ионов зависит от зарядов ядра и иона, радиуса иона и других факторов.
Межмолекулярное взаимодействие.
Если уменьшить расстояние между молекулами газа, увеличивая давление и тем самым уменьшая объем, занятый газом, то при сравнительно низких температурах и при достаточно малых расстояниях между частицами газ превращается в жидкость. Это происходит в результате возрастания сил межмолекулярного взаимодействия. Проявление межмолекулярных сил, под слиянием которых газ превращается в жидкость, а жидкое состояние сменяется твердым, связано с дипольным моментом и поляризуемостью молекул.
Если полярные молекулы находятся на малых расстояниях друг от друга, то они располагаются в определенном порядке. Одноименно заряженные концы диполей взаимно отталкиваются, а противоположные полюса притягиваются; своими разноименными зарядами. Такое взаимодействие называется ориентационным. Чем более полярны молекулы, тем сильнее они притягиваются друг к другу и тем больше ориентационное взаимодействие. Тепловое движение молекул мешает их ориентации, поэтому повышение температуры ослабляет ориентационное взаимодействие.
Одновременно с ориентационным взаимодействием имеет место и поляризация одних полярных молекул другими. Электроны наружных слоев соседних молекул смещаются относительно зарядов ядер: за счет этого у молекул возникают индукционные диполи, которые взаимодействуют между собой и с постоянными диполями. В результате этого молекулы сильнее притягиваются друг к другу. Такое взаимодействие называется индукционным, оно тем сильнее, чем больше дипольный момент и поляризуемость молекул и чем меньше межмолекулярное расстояние. Наложение индукционного взаимодействия на ориентационное увеличивает дипольные моменты и ведет к возрастанию межмолекулярных сил. Индукционное взаимодействие возможно и между полярными и неполярными молекулами. В этом случае под влиянием диполя неполярная молекула поляризуется, возникает индуцированный диполь, который и взаимодействует с постоянным диполем.
Известно, что вещества, состоящие из неполярных молекул, например, инертные элементы, при достаточном понижении температуры переходят в жидкое, а затем и в твердое состояние. Неполярные молекулы и атомы так же взаимодействуют между собой. Объясняется это тем, что вследствие непрерывного движения электронов происходит временное смещение их относительно ядер и в атоме возникает мгновенный диполь. Появление мгновенных диполей приводит к межмолекулярному, так называемому дисперсионному взаимодействию. Силы, обусловливающие это взаимодействие, называются дисперсионными. Дисперсионное взаимодействие присуще всем молекулам — как полярным, так и неполярным. Рассмотренные виды межмолекулярного взаимодействия обычно называют вандервальсовыми. Это взаимодействие является значительно более слабым, чем химическая связь.
Одно и то же твердое вещество в зависимости от условий затвердевания может быть и в кристаллическом и в аморфном состоянии. Твердые тела в кристаллическом состоянии имеют определенную темпера¬туру плавления и геометрическую форму, чем и отличаются от веществ в аморфном состоянии. Для очень многих кристаллов характерна анизотропия — неодинаковость свойств (теплопроводность, электропроводность, механическая прочность, скорость растворения и др.) по разным направлениям. У аморфных веществ эти свойства одинаковы по всем на¬правлениям.
Установлено, что частицы образующие кристалл, находятся в пространстве в строго определенных точках (узлах), совокупность которых составляет кристаллическую решетку. Последняя состоит из отдельных звеньев — элементарных ячеек. Многократное повторение элементарных ячеек и дает кристалл. Типы кристаллических решеток весьма разнообразны. Все разнообразие кристаллических форм можно свести к шести основным кристаллическим системам. В пределах каждой из шести систем различные типы кристаллов обладают сходством углов между гранями, поэтому кристаллические системы называют также сингониями (обладающими равными углами).
С точки зрения природы частиц, образующих кристалл, известно четыре типа структур: атомная, молекулярная, ионная и металлическая. В кристаллах с атомной структурой в узлах решетки находятся атомы, связи между которыми имеют ковалентный характер. Примером кристаллов с такой структурой является алмаз. Атомные решетки образуют и некоторые сложные вещества, например, карбид кремния SiC.
В узлах пространственной решетки веществ с молекулярной структурой находятся полярные или неполярные молекулы, связанные вандерваальсовыми силами. У инертных, элементов молекулы одноатомны, но структура их кристаллических решеток является молекулярной, так как характер взаимодействия частиц обусловлен межмолекулярным силами. Незначительность этих сил приводит к тому, что твердые вещества с молекулярной структурой характеризуются более низкими температурами плавления и кипения и малой твердостью по сравнению с кристаллами, имеющими атомную или ионную структуру. Молекулярные структуры имеют, например, твердые аммиак NH3 н двуокись углерода СО2.
Соединения с ионной структурой имеют высокие температуры плавления и кипения, что говорит о прочности связи в кристалле. Ионную структуру имеют кристаллы хлористого натрия.
От рассмотренных структур существенно отличается металлическая структура, характерная для металлов и их сплавов. В узлах пространственной решетки металлов находятся положительно заряженные ионы, между которыми перемещаются электроны. Валентные электроны, оторвавшись от ионов, не связаны с определенными ионами и пребывают в поле то одного, то другого иона, взаимодействуя с ними. Это взаимодействие называют металлической связью. Большинство металлов имеют высокие температуры плавления и кипения. Со свободным перемещением электронов связаны такие специфические свойства металлов, как высокая электропроводность, хорошая теплопроводность и пластичность.
Различие между структурами твердого тела обусловливается прежде всего природой частиц, образующих вещество, и характером их взаимодействия.
Реальные кристаллы в отличие от идеальных построены значительно сложнее. В реальных кристаллах одно взаимодействие между частицами может накладываться на другое; кроме того в них имеются самые различные дефекты, которые резко изменяют их электрические и другие свойства.
